INTRODUCCIÓN
El
trabajo que a continuación se
presentará contiene
información relacionada con la
"separación de
mezclas", lo
cual tiene una gran importancia porque se conoce sobre
propiedades, sobre los instrumentos y
métodos
adecuados para elaborar dichas mezclas o bien
separarlos.
La correcta separación de mezclas nos ayuda a
poner en práctica todos los métodos
que se presentarán, para separar mezclas; es importante
saber sobre su
estado
físico, y características lo cual a
continuación se presentará…
1) Destilación.
La destilación es el
procedimiento
más utilizado para la separación y
purificación de líquidos, y es el que se utiliza
siempre que se pretende separar un líquido de sus
impurezas no volátiles.

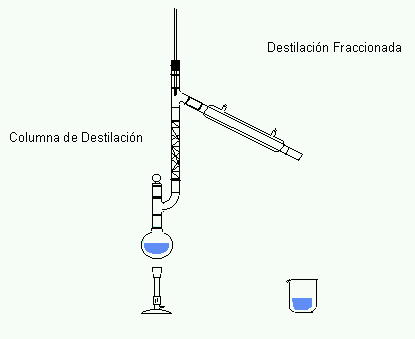
La destilación, como
proceso,
consta de dos fases: en la primera, el líquido pasa a
vapor y en la segunda el vapor se condensa, pasando de nuevo a
líquido en un matraz distinto al de
destilación.
2)
Evaporación.
Consiste en calentar la mezcla hasta el punto de
ebullición de uno de los componentes, y dejarlo hervir
hasta que se evapore totalmente. Este
método se
emplea si no tenemos
interés en
utilizar el componente evaporado. Los otros componentes quedan en
el envase.
Un ejemplo de esto se encuentra en las Salinas.
Allí se llenan enormes embalses con
agua de mar, y
los dejan por meses, hasta que se evapora
el agua,
quedando así un material sólido que contiene
numerosas sales tales como cloruro de sólido, de potasio,
etc…
3)
Centrifugación.
Es un procedimiento que
se utiliza cuando se quiere acelerar la sedimentación. Se
coloca la mezcla dentro de una centrifuga, la cual tiene un
movimiento de
rotación constante y rápido, lográndose que
las partículas de mayor
densidad, se
vayan al fondo y las más livianas queden en la parte
superior.
CENTRIFUGADORA
Un ejemplo lo observamos en las lavadoras
automáticas o semiautomáticas. Hay una
sección del ciclo que se refiere a secado en el cual el
tambor de la lavadora gira a cierta
velocidad, de
manera que las partículas de agua adheridas
a la ropa durante su lavado, salen expedidas por los orificios
del tambor.
4)
Levigación.
Se utiliza una corriente de agua que arrastra los
materiales
más livianos a través de una mayor distancia,
mientras que los más pesados se van depositando; de esta
manera hay una separación de los componentes de acuerdo a
lo pesado que sean.
5)
Imantación.
Se fundamenta en la
propiedad de
algunos materiales de
ser atraídos por un imán. El campo
magnético del imán genera una fuente atractora,
que si es suficientemente grande, logra que los materiales se
acercan a él. Para
poder usar
este método es
necesario que uno de los componentes sea atraído y el
resto no.
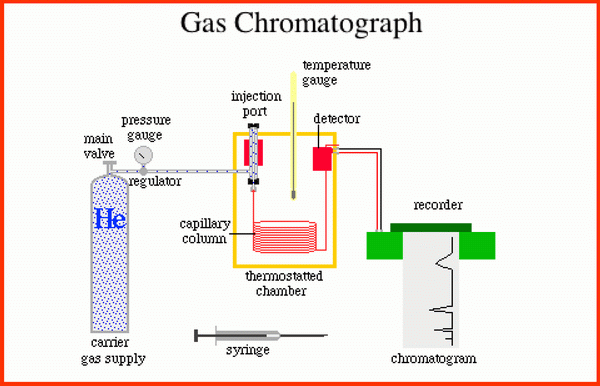
6) Cromatografía de Gases.
La cromatografía es una técnica cuya
base se encuentra en diferentes grados de absorción, que a
nivel superficial, se pueden dar entre diferentes especies
químicas. En la cromatografía de gases, la
mezcla, disuelta o no, es transportada por la primera especie
química
sobre la segunda, que se encuentran inmóvil formando un
lecho o camino.Ambos materiales utilizarán las fuerzas de
atracción disponibles, el fluido (transportados), para
trasladarlos hasta el final del camino y el compuesto
inmóvil para que se queden adheridos a su
superficie.
7)
Cromatografía en Papel.
Se utiliza mucho en
bioquímica, es un proceso donde
el absorbente lo constituye un papel de
Filtro. Una vez corrido el disolvente se retira el papel y se
deja secar, se trata con un reactivo químico con el fin de
poder revelar
las manchas.
En la cromatografía de gases, la mezcla, disuelta
o no, es transportada por la primera especie química sobre la
segunda, que se encuentran inmóvil formando un lecho o
camino.
Ambos materiales utilizarán las fuerzas de
atracción disponibles, el fluido (transportados), para
trasladarlos hasta el final del camino y el compuesto
inmóvil para que se queden adheridos a su
superficie.
8)
Decantación.
Consiste en separar materiales de distinta densidad. Su
fundamento es que el material más denso
En la cromatografía de gases, la mezcla, disuelta
o no, es transportada por la primera especie química sobre
la segunda, que se encuentran inmóvil formando un lecho o
camino.
Ambos materiales utilizarán las fuerzas de
atracción disponibles, el fluido (transportados), para
trasladarlos hasta el final del camino y el compuesto
inmóvil para que se queden adheridos a su
superficie.
9)
Tamizado.
Consiste en separar partículas sólidas de
acuerdo a su tamaño. Prácticamente es utilizar
coladores de diferentes tamaños en los orificios,
colocados en forma consecutiva, en orden decreciente, de acuerdo
al tamaño de los orificios. Es decir, los de orificios
más grandes se encuentran en la parte superior y los
más pequeños en la inferior. Los coladores reciben
el nombre de tamiz y están elaborados en telas
metálicas.


10)
Filtración.
Se fundamenta en que alguno de los componentes de la
mezcla no es soluble en el otro, se encuentra uno sólido y
otro líquido. Se hace pasar la mezcla a través de
una placa porosa o un papel de filtro, el sólido se
quedará en la superficie y el otro componente
pasará.
Se pueden separar sólidos de partículas
sumamente pequeñas, utilizando papeles con el
tamaño de los poros adecuados.